pH buforów. Wyprowadzenie równania Hendersona-Hasselbalcha dla buforu octanowego, amonowego i fosforanowego.
Specyficznym rodzajem roztworów są tzw. roztwory buforowe, które według definicji mają zdolność do utrzymywania stałego pH pomimo dodawania niewielkich ilości mocnych kwasów lub zasad oraz podczas rozcieńczania takiego roztworu. pH buforu można obliczyć stosując tzw. równanie Hendersona-Hasselbalcha, które zmienia swą postać w zależności od rodzaju roztworu buforowego.
1. pH buforu octanowego
Bufor octanowy jest przykładem buforu o pH mniejszym od siedmiu,a więc jest buforem kwasowym. Roztwór taki składa się ze słabego kwasu i soli tego kwasu z mocnym wodorotlenkiem; w przypadku buforu octanowego jest to oczywiście kwas octowy CH3COOH oraz jego sól sodowa - octan sodu CH3COONa.
W takim roztworze zachodzą dwie reakcje. Pierwszą z nich jest dysocjacja kwasu octowego, drugą dysocjacja octanu; obydwie przemiany ilustrują reakcje:
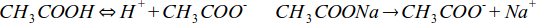
Warto zauważyć, że sól dysocjuje całkowicie(czyli cała ilość octanu sodu rozpada się na jony), natomiast kwas tylko w niewielkim stopniu. Stan taki pozwala opisać dysocjację kwasu octowego stałą dysocjacji kwasowej Ka oraz przyjąć kilka koniecznych uproszczeń:
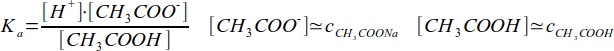
Jako, że sól dysocjuje całkowicie, a kwas tylko w niewielkim stopniu można bez większego błędu zaniedbać ilość jonów octanowych pochodzących z dysocjacji kwasu i przyjąć, że ich równowagowe stężenie jest równe stężeniu octanu sodu. Podobnie jest w przypadku stężenia równowagowego kwasu, gdyż duża ilość powstałych w wyniku dysocjacji soli jonów octanowych cofa praktycznie całkowicie dysocjację kwasu, dlatego można przyjąć, że jest ono równe stężeniu początkowemu.
Powyższe przybliżenia podstawiamy do równania stałej dysocjacji:
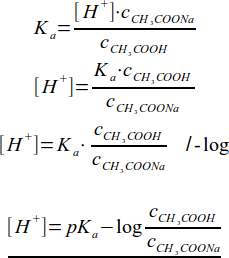
Otrzymaną zależność przekształcamy wyciągając stężenie równowagowe kationów wodorowych, następnie obie strony logarytmujemy ujemnym logarytmem dziesiętnym. Ujemny logarytm dziesiętny ze stałej dysocjacji jest nazywany wykładnikiem stałej dysocjacji i oznaczany jako pKa. Ostatecznie otrzymujemy zależność określającą pH buforu octanowego(równania Hendersona-Hasselbalcha da tegoż buforu).
2. pH buforu amonowego
Bufor amonowy jest buforem o pH większym od 7, dlatego jest buforem zasadowym. Bufory zasadowe składają się ze słabej zasady oraz soli tej zasady z mocnym kwasem; w przypadku buforu amonowego jest to amoniak oraz azotan(V) amonu.
Podobnie jak w przypadku buforu octanowego w roztworze zachodzą dwie reakcje - hydrolizy amoniaku oraz dysocjacji azotanu(V) amonu:

Amoniak, jako słaba zasad, dysocjuje tylko w niewielkim stopniu, natomiast sól zawsze dysocjuje całkowicie. Układamy wyrażenie na stałą dysocjacji zasadowej amoniaku oraz przyjmujemy przybliżenia:
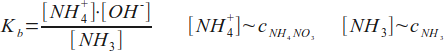
Uzasadnienie przybliżeń jest takie samo, jak w przypadku buforu octanowego: duża ilość jonów NH4+ pochodzących z dysocjacji soli cofa hydrolizę amoniaku, dlatego bez większego błędu można przyjąć, że stężenie równowagowe tychże jonów jest równe początkowemu stężeniu soli; drugie przybliżenie bezpośrednio wynika z pierwszego - jeśli jony amonowe cofnęły hydrolizę amoniaku, to możemy przyjąć, że jego stężenie równowagowe jest równe stężeniu początkowemu. Podstawiamy przybliżenia:
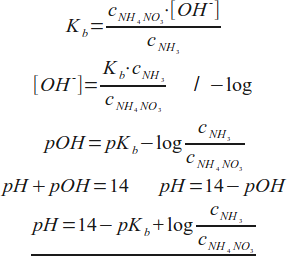
Postępowanie jest identyczne jak przy buforze octanowym, jednak po dokonaniu przekształceń otrzymujemy równość określającą pOH, nas natomiast interesuje pH, dlatego korzystamy z zależności wynikającej z iloczynu jonowego wody i wyprowadzamy zależność opisującą pH roztworu amonowego.
3. pH buforu fosforanowego
Bufor fosforanowy jest dość specyficznym rodzajem buforu, bowiem jest on złożony z wodorosoli kwasu ortofosforowego(V). Najczęściej stosuje się wodoroortofosforan(V) sodu oraz diwodoroortofosforan(V) sodu. Gdy podane sole wprowadzi się do roztworu obie dysocjują w 100%, więc nie można ułożyć sensownej stałej równowagi którejś reakcji. Interesująca jest natomiast reakcja pomiędzy produktami dysocjacji tych soli:
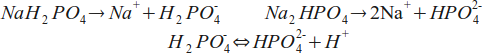
Jon diwodoroortofosforanowy(V) pochodzący z dysocjacji diwodoroortofosforan(V) sodu rozpada się częściowo na jon wodoroortofosforanowy(V); jest to reakcja, która zachodzi tylko w częściowym stopniu, dlatego możemy określić ją stałą dysocjacji:
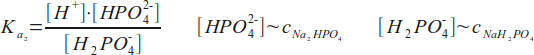
Należy zaznaczyć, że jest to druga stała dysocjacji kwasu ortofosforowego(V)(Ka2). Powyższe uproszczenia wynikają bezpośrednio ze 100% dysocjacji soli użytych do sporządzenia roztworu - zarówno stężenie jonów H2PO4- jak i HPO42- pochodząca z rozpadu soli jest tak duże, że możemy nie uwzględniać jego zmiany będących wynikiem reakcji opisywanej przez stałą dysocjacji, słowem przyjmujemy, że stężenie wymienionych jonów jest równe stężeniu początkowemu odpowiednich soli. Podstawiamy i przekształcamy równanie:
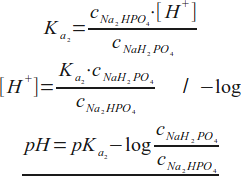
W tym przypadku przekształcenie sprowadza się tylko do wyciągnięcia stężenie kationów wodorowych i zlogarytmowania.

